קשר קוולנטי
קשר קוֹוָלֵנְטִי (בעברית: קשר שיתופי) הוא קשר כימי בין שני סוגי אטום על ידי שיתוף אלקטרון ערכיות (ברמה הקוולנטית).[1]
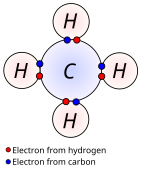
האל-מתכות משתפות ביניהן מספר אלקטרונים מאלקטרוני הערכיות שלהם. בקשר קוולנטי כל אטום משני אטומי הקשר תורם לקשר מספר זהה של אלקטרונים – ועל שם כך הקשר נקרא "קוולנטי" ("קו" – שיתוף, "ולנט" – ערכיות).
קשר קוולנטי הוא אחד משלושת סוגי הקשרים הכימיים הראשוניים, יחד עם קשר יוני וקשר מתכתי, ומהווה אחד מן הקשרים הכימיים החזקים ביותר.
אלקטרוני הקשר ממלאים יחדיו אורביטל מולקולרי, כאשר צפיפות ענן האלקטרונים באורביטלים (אלקטרושליליות) אלו סביב אטומי הקשר יכולה להיות:
- זהה – במקרה זה הקשר ייקרא קשר קוולנטי טהור (לדוגמה, הקשר המחבר בין אטומי פחמן ביהלום)
- שונה – אז הקשר ייקרא קשר קוולנטי קוטבי (כמו הקשר בין מימן לחמצן במים).
היסטוריה
עריכה- ערך מורחב – היסטוריה של הכימיה
תאוריות ראשונות של קשרים כימיים פותחו לאחר גילוי האלקטרון על ידי ג'יי ג'יי תומסון. באפריל 1897 פרסם תומסון את גילוי האלקטרון בעקבות מחקריו על שפופרת קרן קתודית. הניסויים שלו הציעו לא רק שקרניים קתודיות קלות ביותר מפי 1,000 מאטום המימן, אלא גם שהמסה שלהם זהה ללא תלות ביסוד ממנו באו. הוא הסיק שהקרניים בנויות מחלקיקים מאוד קלים, בעלי מטען שלילי, חלקיקים המהווים רכיב אוניברסלי של מבנה האטומים. בשנת 1904 תומסון הציע מודל ראשון של מבנה אטום, המכונה מודל עוגת הצימוקים. במודל האטומי שלו הניח תומסון שקשרים כימיים נוצרים בעזרת כוחות אלקטרוסטטיים שמועברים בין האטומים. מהנחה זאת נובע כי קשר כימי חייב להיות קוטבי.
ארנסט רתרפורד ביצע את ניסוי רתרפורד שהראה כי המטען חיובי של האטום מרוכז באזור קטן מאוד בתוך האטום ולכן יש לדחות את "מודל עוגת הצימוקים". ניסויים אלו הובילו את רתרפורד להציע את המודל הפלנטרי של האטום בשנת 1911. במודל זה הוצג לראשונה הרעיון של גרעין האטום. בשנת 1913 שכלל נילס בוהר את המודל הפלנטרי של האטום והציג את מודל האטום של בוהר.
מכיוון שלא ניתן להסביר תכונות של תרכובות אורגניות בעזרת קשר קוטבי, התברר שאמורים להתקיים גם קשרים לא קוטביים ולא רק קוטביים כפי שהסביר תומסון. בשנת 1916 טען לראשונה גילברט ניוטון לואיס שקשרים לא קוטביים מתבססים על זוג משותף של אלקטרונים.[2] ובכך הגה את הרעיון של קשר קוולנטי.
אלקטרונים
עריכהבדומה לכל הקשרים הכימיים הראשוניים: הבסיס ליצירת קשר קוולנטי הוא השאיפה של האטומים להיות בעלי סידור אלקטרונים שלם, בו כל הקליפות והאורביטלים בהן, מלאות או ריקות לחלוטין מאלקטרונים, בדומה לסידור האלקטרונים של אטומי הגזים האצילים. במקרה של מפגש בין שני אטומי אל-מתכת, האטומים מושכים את האלקטרונים אחד של השני ומספקים שאיפה זו על ידי שיתוף מספר אלקטרונים אשר יחדיו ימלאו את רמת האלקטרונים המאוכלסת החיצונית ביותר שלהם. הרי שכל הרמות מתחת כבר מלאות, מילוי אותה רמה יביא לסידור אלקטרונים שלם.
סידור האלקטרונים
עריכהכל אורביטל יכול להכיל אלקטרון בודד עד שניים. לאלקטרונים עדיף אנרגטית להתפרס באורביטלים בעלי רמת אנרגיה זהה, ביחידים. על פי כלל הונד רק ברגע שכל האורביטלים מאוכלסים על ידי אלקטרון בודד יתמלאו אורביטלים מאוכלסים כבר. ובשום צורה לא לפני כך.
כתוצאה מכך, באטומים אל-מתכתיים שאינם גזים אצילים, מספר האלקטרונים אשר "חסרים" לסידור אלקטרונים מלא זהה למספר האלקטרונים הבודדים. מספר זה הוא מספר הקשרים הקוולנטיים אשר האטום יכול ליצור עם אטומים אחרים.
לדוגמה: לאטום חמצן O יש שישה אלקטרונים בקליפתו החיצונית, אשר בה ארבעה אורביטלים. על כן, ישנם שני זוגות אלקטרונים (בשני אורביטלים), ושני אלקטרונים יחידים (בשני אורביטלים נפרדים). ניתן לראות הייצוג אלקטרוני הערכיות לפי דיאגרמת לואיס (אלקטרונים אלו מסומנים בנקודות סביב האטום) את התפלגות האלקטרונים:
בקשר קוולנטי, חולקים שני אטומים את האלקטרונים החופשיים שלהם ברמת האנרגיה הגבוהה ביותר, ליצירת אורביטלים משותפים (בהם זוגות אלקטרונים) המצויים בין שני האטומים. קשרים קוולנטיים אותם יוצר אטום עם אטומים אחרים משלימים את מצבו האלקטרוני של האטום למצב הדומה למצבו הנייטרלי של אטום גז אציל. ישנם מקרים היוצאים מכלל זה, לדוגמה, קשר מתכתי או מקרים בהם האלקטרונים מהרמות הפנימיות משתתפים בקשר.
בין שני אטומים עשוי להיווצר קשר קוולנטי יחיד (זוג אלקטרונים משותף), כפול (שני זוגות אלקטרונים משותפים) או משולש (שלושה זוגות). קשר מרובע ומחומש עשוי להתקיים בין מתכות וגם בין אל מתכות.
קשר קוולנטי מסומן בקווים בין שני האטומים.
דוגמאות לסימוני קשרים (לפי מספר האלקטרונים החופשיים)
קשר קוולנטי יחיד בין אטום מימן לאטום פלואור:
קשר קוולנטי כפול בין אטום חמצן לאטום גופרית:
קשר קוולנטי משולש בין אטום זרחן לאטום חנקן:
סוגי הקשרים הקוולנטיים
עריכהישנם שני סוגים של קשרים קוולנטיים. קשר קוולנטי מלא, וקשר קוולנטי קוטבי. בקשר קוולנטי מלא מדובר בשתי אל מתכות זהות שיוצרות קשר קוולנטי ואז אלקטרוני הערכיות שלהם נמצאים פעם באטום הראשון ופעם בשני. בקשר קוולנטי קוטבי מדובר בשתי אל מתכות שונות שמתרכבות רק כשלאחת יש אלקטרושליליות גבוהה יותר (אין שני יסודות בעלי אלקטרושליליות זהה) ולכן רוב הזמן אלקטרוני הערכיות נמצאים אצל האטום בעל האלקטרושליליות הגבוהה ביותר, אפילו שכמות זמן לא מבוטל האלקטרונים יהיו אצל בעל האלקטרושליליות הנמוכה יותר. לדוגמה, מימן (H) שמתרכב עם פלואור (F). לפלואור יש אלקטרושליליות גבוהה יותר מאשר למימן, אפילו שלמימן יש אלקטרושליליות גבוהה יחסית לשאר היסודות בטבלה ולכן רוב הזמן אלקטרוני הערכיות יהיו אצל פלואור אבל גם חלק מהזמן אצל המימן.
מבנה מרחבי
עריכהצורתה המרחבית של המולקולה הנוצרת בזכות יצירתו של קשר קוולנטי נקבעת על-פי נטייתם של זוגות האלקטרונים להיות רחוקים זה מזה ככל הניתן בשל מטענם החשמלי השלילי. לכן המרחק הרצוי הוא המרבי ובכל מבנה הזוויות הנוצרות על ידי שני אטומים הקשורים כל אחד לאטום שלישי (וכך נוצרת זווית בין 3 אטומים – שתקרא להלן "הזווית בין הקשרים") הן שוות. סביב כל אטום במולקולה כזו (מלבד מימן והליום) מצויים ארבעה אורביטלים (בלעדיים לאטום או משותפים בקשר קוולנטי) המסודרים לפיכך בפינותיו של ארבעון משוכלל (פירמידה בעלת בסיס משולש שבה כל הפאות שוות זו לזו).
כוח הדחייה של זוגות אלקטרונים שאינם קושרים קשרים קוולנטיים אלא נמצאים סביב אטום אחד הוא גדול במעט משל הזוגות היוצרים את הקשר, שכן הראשונים קרובים יותר לגרעין האטום. כמו כן, כוח הדחייה של קשר קוולנטי כפול גדול משל יחיד, וכוח הדחייה של קשר משולש גדול משל קשר כפול.
דוגמאות לסידור הזוגות במרחב:
מולקולת מתאן, שבה אטום פחמן מקושר לארבעה אטומי מימן, לכל אחד בקשר קוולנטי יחיד:
צורת תיאור זו היא מישורית, אך מציינת פיזור ארבעוני של הקשרים במרחב.
מולקולת אמוניה, שבה אטום חנקן, לו זוג אלקטרונים אחד ברמת האנרגיה האחרונה, מקושר לשלושה אטומי מימן, לכל אחד בקשר קוולנטי יחיד:
גם במקרה זה התיאור הגרפי מציין פיזור מרחבי בצורת פירמידה. הזווית שבין כל שני קשרים קבועה, אך הזווית בין זוג האלקטרונים 'השייך' לאטום (שתי הנקודות) גדולה מעט מהזווית בין כל שני קשרים.
מולקולת מים, שבה אטום חמצן, לו שני זוגות אלקטרונים ברמת האנרגיה האחרונה, מקושר לשני אטומי מימן, לכל אחד בקשר קוולנטי יחיד:
שלושת האטומים יוצרים צורה מישורית, אך כל זוגות האלקטרונים מפוזרים במרחב בצורת ארבעון. הזווית בין הקשרים היא זווית קהה, שכן כוח הדחייה של זוגות האלקטרונים גדול יותר משל הקשר הקוולנטי.
מולקולת "ציאניד" (מימן ציאנידי), שבה אטום פחמן מחובר בקשר קוולנטי משולש לאטום חנקן ובקשר קוולנטי יחיד לאטום מימן.
- למולקולה זו סידור מישורי של קו ישר.
עוצמת הקשר בין שני האטומים גדלה ככל שיש ביניהם יותר קשרים קוולנטיים. כמו כן, ככל שהאלקטרושליליות (יכולת המשיכה של אלקטרונים) של אטום מסוים גבוהה יותר, גדלה עוצמת הקשרים אותם הוא יוצר.
מכיוון שהאלקטרושליליות של היסודות השונים שונה זו מזו, בכל קשר בין אטומים (מלבד מקרים בהם המולקולה היא סימטרית לחלוטין בציר זה) לאחד האטומים כוח משיכה גדול יותר, והאלקטרונים של הקשר הקוולנטי ייטו להיות בקרבתו. כך נוצרים הבדלים יחסיים של מטען בין שני האטומים. הבדלים יחסיים אלו עשויים להשפיע על שאר הקשרים של האטומים.
לדוגמה, במולקולת הציאניד (בדוגמה לעיל), לאטום הפחמן (C) אלקטרושליליות גבוהה משל המימן (H), ולכן מטענו היחסי של המימן חיובי ושל הפחמן שלילי. כמו כן, לחנקן (N) אלקטרושליליות גבוהה משל הפחמן (C), ולכן מטענו היחסי של החנקן שלילי. מכיוון שמטענו של הפחמן שלילי בשל הקשר עם המימן, וחיובי בשל הקשר עם החנקן, מטענו הכולל הוא בקירוב נייטרלי.
קישורים חיצוניים
עריכה- ארז גרטי, מהו קשר קוולנטי?, במדור "מאגר המדע" באתר של מכון דוידסון לחינוך מדעי, 25 ביוני 2011
- אבי סאייג, איך אני יכולה לדעת אם אטומים מסוימים ייצרו קשר קוולנטי או יוני או אחר ביניהם?, במדור "שאל את המומחה" באתר של מכון דוידסון לחינוך מדעי, 12 אוגוסט 2010
- קשר קוולנטי, באתר לרגו
- קשר קוולנטי, באתר אנציקלופדיה בריטניקה (באנגלית)
הערות שוליים
עריכה- ^ ארז גרטי. "מהו קשר קוולנטי?". אתר מכון דוידסון לחינוך מדעי
- ^ Lewis, Gilbert N.. “The Atom and the Molecule.” Resonance 24 (1916): 793-817.