תגובה אקסותרמית
תְּגוּבָה אֶקְסוֹתֶרְמִית (מיוונית: ἔξω, אקסו – החוצה ו־θέρμη תֶרמֶה – חום) היא תגובה כימית הפולטת אנרגיה לסביבה, להבדיל מתגובה אנדותרמית, הצורכת אנרגיה מהסביבה. בתגובה אקסותרמית אנתלפיית התגובה היא שלילית.
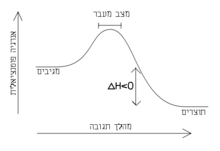
אף על פי שסך מאזן האנרגיה של תגובה אקסותרמית הוא כך שנפלטת אנרגיה לסביבה, במקרים רבים יש להשקיע אנרגיה ראשונית כדי להתחיל את התגובה, וזאת כדי להתגבר על המחסום האנרגטי הראשוני שלעיתים נגרם מסיבות שונות:
- מצב מעבר לא יציב (בתגובת SN2 אקסותרמית למשל)
- צורך לפרק את המגיבים לפני התרכבותם מחדש (בתגובה מומסת למשל)
- צורך בסימטריית תגובה ספציפית, מה שמחייב תנועת חלקיקים מהירה (כמו בהתלכדות רדיקלים למשל, תגובה מאוד אקסותרמית)
- חזרת התגובה לצד ההפוך, האנדותרמי (בתגובות שיווי משקל)
- התגברות על דחייה בין אלקטרונים (בתגובות חמצון-חיזור למשל)
- צורך "לעורר" חלקיק (אטום, מולקולה או יון) שנמצא בריכוז נמוך. דוגמה לכך היא שרפה. שרפה היא תגובה אקסותרמית, אך דרוש מקור חום כי רק כשישית מהאוויר הוא חמצן.
אנרגיה ראשונית זו קרויה אנרגיית שפעול או אנרגיית אקטיבציה. ללא המחסום האנרגטי הראשוני, תגובות אקסותרמיות היו עלולות להיות ספונטניות. בתגובת בעירה, לדוגמה, קודם יש למסור אנרגיה לחומר הבעירה ורק כאשר יתחיל לבעור, האנרגיה העצמית שלו תגרום להמשך התגובה.
דוגמאות לתגובות אקסותרמיות:
- הגבת חומרים הידרופיליים עם מים (כמו המסת אבקת גבס, חומצה גופרתית או סודה קאוסטית והגבת מתכת אלקלית)
- תגובות סתירה
- הספגת חומר היגרוסקופי חזק במים (כמו סידן כלורי)
- תגובות SN2 וחמצון-חיזור חזקות
- המסת מתכות מעבר בחומצות חזקות (לדוגמה, ברזל, אלומיניום או אבץ בחומצת מלח)
חישוב אנתלפיית תגובה
עריכהH1 – תכולת האנרגיה (אנתלפיה) של המגיבים.
H2 – תכולת האנרגיה (אנתלפיה) של התוצרים.
H∆ – אנתלפיית התגובה – החום הנפלט או הנקלט בתגובה (כאשר החומרים מגיבים לפי היחסים במשוואה).
H2 - H1 = ∆H
H<0∆ – תגובה אקסותרמית (H2 < H1) נפלטת אנרגיה מהמערכת.
0<H∆ – תגובה אנדותרמית (H2 > H1) נקלטת אנרגיה למערכת.
ראו גם
עריכה