ריצוף DNA
ריצוף DNA (בעברית הַרְצָפָה[1]) הוא תהליך של פענוח סדר הנוקלאוטידים בקטע DNA. פיתוחן של שיטות מהירות לריצוף DNA האיץ מחקרים ביולוגיים ורפואיים רבים.

הידע על התוכן של רצפי DNA נהיה חשוב למחקר בסיסי, וכן לתחומים רבים נוספים, כגון אבחון רפואי, ביוטכנולוגיה, סיסטמטיקה, וירולוגיה וזיהוי פלילי. ככל שהטכנולוגיה נהיית זולה ומהירה יותר, ניתן להרחיב את השימוש בגנומיקה אישית.
DNA
עריכה- ערך מורחב – DNA
DNA הוא החומר התורשתי של כלל היצורים החיים[א], אשר מורכב מארבעה נוקליאוטידים: אדנין (A), תימין (T), גואנין (G) וציטוזין (C). ה-DNA היא מולקולה יציבה מאוד כאשר היא נמצאת בדו-גדיל, כלומר, סליל כפול. במבנה זה נוצרים זיווגי בסיסים, שבהם A ממוקם מול T, ו-G מול C. לפיכך, ידע אודות גדיל אחד מספיק כדי להסיק את תוכנו של הגדיל המשלים. מכיוון שה-DNA משותף לכלל היצורים, עקרונות הריצוף זהים. לעיתים בסיסים אלו יכולים לעבור התמרות כימיות שונות, כגון מתילציה, וטכנולוגיות שונות פותחו כדי לפענח גם אותן. מתוך רצף ה-DNA של יצור, חלקים מסוימים עוברים תהליך שעתוק, שבו נוצר RNA ממקטע מסוים באחד הגדילים. מקטע RNA זה יכול לעבור תהליך של תרגום, שבו כל שלושה נוקליאוטידים מומרים בחומצה אמינית אחת. שרשרת חומצות האמינו יוצרת חלבון.
שיטות הריצוף מתרכזות במולקולת ה-DNA מסיבות טכניות. RNA משועתק מרצף ה-DNA, ובניגוד למבנה הגדיל הכפול האופייני בדרך כלל למולקולות DNA, לרוב RNA מצוי בטבע במבנה של גדיל בודד בלתי יציב. כדי לאפשר ריצוף RNA, ניתן להוסיף שלב הכנה נוסף בו הוא מומר ל-cDNA, ומרוצף ככל רצף DNA אחר.
היסטוריה
עריכהגילוי חומצות הגרעין וההרכב הכימי שלהן
עריכהפרידריך מישר (1844–1895), ביו-כימאי שווייצרי שהתעניין במבנה התא, ערך אנליזה כימית על תאי הדם הלבנים (לוֹיְקוֹציטים) אותם לקח מתחבושות מלאות מוגלה שסיפקה לו קליניקה כירורגית סמוכה. במחקריו הוא שם לב שמלבד החלבונים הממלאים את נוזל התא (הציטופלזמה) ישנו בתא חומר נוסף שאינו חלבון. בטכניקה מיוחדת הוא שחרר את גרעין התא מתוך התא מבלי לפגוע בו וניתח את מבנהו הכימי. או אז התברר לו שהחומר הכימי שבגרעין שונה באופן מהותי מחלבון, וכי בשונה מכל חלבון – הוא מכיל כמויות משמעותיות של זרחן. את התרכובת המיוחדת הזו המאכלסת את גרעין התא הוא כינה בשם "נוּקְלֵאִין" (nuclein, "גרעינן").[ב] בקיץ 1869 הוא אימת את השערתו שתרכובת כימית זו מקורה בגרעיני התאים, וכי היא מופיעה לא רק בתאי דם לבנים אלא בתאים רבים אחרים; תאי שמרים, כליות, כדוריות דם אדומות ורקמות אחרות. תגליתו התפרסמה באביב 1871 לאחר שבוצעו ניסויים נוספים שאיששו את המאמר.[2] בשנים שלאחר מכן הוא המשיך לחקור את גרעין התא בתאי זרע של דגי סלמון, המייצרים כמות גדולה של תאי זרע. המיוחד בתא הזרע הוא שהוא לא מכיל כמעט חומרים אחרים מלבד הגרעין, שכן הוא נועד להתמזג לתוך תא הביצית, מה שהקל על חקירת הגרעין. ואכן במחקרו זה הוא גילה שה"נוקלאין" הוא למעשה מולקולה גדולה הבנויה ממספר קבוצות של חומצות, ובשנת 1889 טבע תלמידו, ריכרד אלטמן (Richard Altmann; 1852–1900), את המונח "חומצה נוקלאית" (nucleic acid, חומצת גרעין).[3]
ההרכב הכימי של חומצות הגרעין היה ידוע ברובו למישר וכן למעבדות אחרות. הן הכילו קבוצת סוכר הנקראת ריבוז (למעשה: דיאוקסיריבוז), קבוצת פוספט ובסיס המורכב מחנקן. כבר במאה התשע עשרה היה ידוע כי הבסיסים החנקניים של ה-DNA מורכבים מארבעה סוגים – אדנין, גואנין, ציטוזין ותימין.
אולם למעשה, באותה תקופה סברו כולם, וכך גם מישר, כי חומצת גרעין זו משמשת כעזר בנייה לתא או לחלבונים, וכי היא אינה ממלאת תפקיד מהותי בהעברת התכונות במהלך ההפריה.
ההתמקדות בחלבונים
עריכהמתחילת המאה העשרים היה ברור לחוקרים בתחום כי הגנים, החומר התורשתי של האורגניזמים, ממוקמים בכרומוזומים שהם (כפי שהיה ידוע אז) מעין סבך של חלבונים וחומצות גרעין הנמצאים בגרעין התא של כל יצור חי. מבין שני המרכיבים הללו של הכרומוזומים, חומצות הגרעין והחלבונים, סברו רוב החוקרים כי דווקא החלבונים הם היכולים לשמש כנושאי המטען הגנטי, שכן רק להם מורכבות ורב-גוניות אשר יכולות, כך הייתה ההנחה, לשאת את המידע התורשתי. לעומתם, חומצות הגרעין הן מולקולות "פשוטות" יותר ואינן מורכבות כמו חלבונים. לפיכך התמקדו המאמצים העיקריים עד לתחילת שנות ה-50 בניסיונות להבין את מבנה החלבון, וכפועל יוצא מכך, להבין את אופן ההורשה של המידע הגנטי.
לינוס פאולינג, שנמנה עם החוקרים שהקדישו את מרבית חייהם המקצועיים לחקר מבנה החלבונים, סבר רוב הזמן כמרבית עמיתיו, כי החלבון הנמצא בכרומוזום נושא, ככל הנראה, את המטען התורשתי. כך אמר פאולינג עצמו בעניין זה בדיעבד:
"I knew the contention that DNA was the hereditary material, but I didn't accept it," Pauling said about his thinking in 1951. "I was so pleased with proteins, you know, that I thought that proteins probably are the hereditary material rather than nucleic acids-but that of course nucleic acids played a part. In whatever I wrote about nucleic acids, I mentioned nucleoproteins, and I was thinking more of the protein than of the nucleic acids.
— [4]
בשנת 1951 פרסם פאולינג יחד עם רוברט קורי, סגנו במעבדה בקליפורניה, מספר מאמרים שהיוו פריצת דרך בחקר מבנה החלבונים, והיו הראשונים שהצליחו לתאר את מבנה החלבון ברמה המולקולרית. באפריל 1951 פרסמו השניים את המוטיבים המבניים המרכזיים במבנה השניוני של חלבונים – סליל אלפא ומשטח בטא.[5] והקדימו בכך את צוות החוקרים במעבדת קוונדיש באוניברסיטת קיימברידג' שבראשה עמד הפיזיקאי, חתן פרס נובל לפיזיקה, ויליאם לורנס בראג, חלוץ הקריסטלוגרפיה באמצעות קרני רנטגן.
במאי 1952 נערכה ועידה בנושא מבנה החלבונים באנגליה, אולם מלינוס פאולינג נמנע מלהשתתף בה, כי משרד החוץ האמריקאי סירב להנפיק לו דרכון, עקב פעילותו הפוליטית. היה זה בשיא המקארתיזם. יש הסוברים כי עקב ביטול ביקור זה נמנע מפאולינג מידע על עבודתה של פרנקלין (ראו למטה) שהיה מוביל אותו לפענוח המבנה.[6] אולם, מנגד, פאולינג קיבל דרכון (לתקופה מוגבלת) זמן קצר אחר כך וסייר מחוץ לארצות הברית.[7]
מחלבונים אל חומצות הגרעין
עריכהעד לתחילת שנות ה-50 הניסיון היחיד כמעט לטעון כי ייתכן שנושאי המטען הגנטי אינם החלבונים שבכרומוזום אלא דווקא חומצות הגרעין, הופיע במאמר משנת 1944 שלא רבים הבחינו בו, של אוסוולד אייברי (Oswald Avery) ואחרים. אייברי, חוקר במכון רוקפלר בניו יורק, פרסם מאמר ביחד עם עמיתיו במגזין לרפואה ניסויית, ובו דיווח על האפשרות של העברת המידע הגנטי באמצעות מולקולת ה-DNA לבדה בבקטריה בשם Pneumococcus. היו שטענו כנגד מחקרו של אייברי כי מנגנון זה קיים ככל הנראה רק בחיידקים, ושעצם קיומו אינו מצביע על כך שהחומר התורשתי של שאר האורגניזמים נמצא גם הוא ב-DNA, ואולם כאמור, מעטים שמו לב למידע זה והקהילה המדעית הוסיפה להתמקד במחקר החלבונים.
ניסוי נוסף של שני חוקרים, אלפרד הרשי ומרתה צ'ייס (שקרוי היום ניסוי הרשי-צ'ייס), נערך בשנת 1952 והיווה חיזוק לגישה לפיה החומר התורשתי נמצא בחומצות הגרעין הנמצאות בגרעין התא ולא בחלבונים. הרשי וצ'ייס חקרו בקטריופאגים הבנויים הן מחלבונים והן מ-DNA. בניסוי שלהם הם סימנו בסמנים כימיים (איזוטופים של גופרית ושל זרחן) את החלבונים של הבקטריופאגים והן את ה-DNA שלהם. לאחר מכן הניחו להם להדביק אוכלוסייה של חיידקים. בבדיקת אוכלוסיית החיידקים המודבקת התגלה כי החלבונים נשארו מחוץ לתאים שהודבקו ואילו ה-DNA נמצא בתוכם, דבר שאישש את המסקנה כי ה-DNA מהווה את החומר התורשתי, שכן הוא החומר שחדר לתא הפונדקאי על מנת להדביק אותו.
בסוף שנות ה-40 של המאה העשרים הבחין ארווין צ'רגף, מדען יהודי שפעל באוניברסיטת קולומביה, כי ה-DNA של כל תא בכל אורגניזם מכיל כמות גואנין שווה לכמות הציטוזין וכמות אדנין השווה לכמות התימין. הוא גם שם לב לכך שהתפלגות סוגי הבסיסים שונה מעט מאורגניזם לאורגניזם. הבחנות אלה נודעו כחוקי צ'רגף. החוקים חיזקו את הרעיון כי החומר הגנטי הוא ה-DNA, לאור השונות שהוא יכול לגלות בין אורגניזמים. השוויון בין בסיסי פירימידין ופורין רמז על מבנה של זוגות.
גילוי תפקיד ומבנה ה-DNA
עריכה- ערך מורחב – גילוי מבנה ה-DNA
DNA התגלה לראשונה על ידי פרידריך מישר בשנת 1869 אך נזנח מבחינה מחקרית מכיוון שהתפיסה המדעית המקובלת באותה תקופה הייתה שחלבונים משמשים כחומר התורשתי. בשנת 1944 התפרסם ניסוי איוורי-מקלאוד-מקארתי, המראה כי DNA מסוגל להעביר תכונות ביולוגיות בין חיידקים. בשנת 1953 ג'יימס ווטסון ופרנסיס קריק פרסמו את מודל הסליל הכפול, המתבסס על פענוח תצלום קריסטלוגרפיה בקרני רנטגן של מבנה ה-DNA שנעשה על ידי רוזלינד פרנקלין. לפי מודל זה, DNA מורכב מסליל כפול המחובר בקשרי מימן בין זוגות הנוקליאוטידים. מבנה זה מאפשר השלמת סליל אחד מתוך רצף הסליל הנגדי, מה שמאפשר את העברת המידע במלואו בתורשה.
התשתית לפענוח רצף חומצות האמינו של חלבון הונח על ידי פרדריק סנגר, שהצליח לפענח בשנת 1955 את רצף חומצות האמינו המרכיבות אינסולין. גילוי זה הוכיח בצורה חד-משמעית שחלבונים מורכבים מישויות כימיות בעלות תכונות מולקולריות מסוימות, ולא מתמהיל אקראי של חומרים, ואתגר את הביולוגים למצוא את התבנית שקובעת איך מרצף ה-DNA נוצרים חלבונים. פרנסיס קריק השתתף בסוף שנת 1954 בסדרת הרצאות שהעביר פרדריק סנגר, שלאחריהן פיתח את הדוֹגמה המרכזית של הביולוגיה המולקולרית, אותה פרסם בשנת 1958. לפי דוֹגמה זו, DNA יוצר חלבונים באמצעות RNA.
שיטות ריצוף מוקדמות
עריכההשיטה הראשונה לפענוח רצף DNA פותחה על ידי ריי וו באוניברסיטת קורנל בשנת 1970. שיטה זו התבססה על הארכת תחל וסימון נוקליאוטידים, עקרונות העומדים בבסיס שיטות ריצוף רבות. באמצעות שיטה זו הצליח לרצף חלק מהגנום של בקטריופאג' למדא, ובמשך שלוש השנים הבאות הראה וו יחד עם עמיתיו ששיטה זו ניתנת ליישום על כל רצף DNA שניתן לתכנן לו תחל ספציפי. סנגר שיכלל אסטרטגיה זו והצליח לקצר משמעותית את התהליך, ופרסם את שיטתו בשנת 1977[8]. עם זאת, שיטת סנגר מוגבלת לאורך של מאות בסיסים. שיטה נוספת פותחה על ידי וולטר גילברט ואלן מקסם באוניברסיטת הרווארד, המתבססת על דגרדציה כימית.
ריצוף גנומים שלמים ופיתוח מכונות ריצוף
עריכההגנום הראשון שרוצף במלואו הוא של הבקטריופאג' ΦX174 בשנת 1977, באורך של 5,386 זוגות בסיסים. בשנת 1984 חוקרים פרסמו את רצף ה-DNA של נגיף אפשטיין-בר, באורך כולל של 172,282 זוגות בסיסים. זוהי נקודת ציון חשובה מכיוון שלחוקרים לא היה שום ידע מוקדם על תוכן רצף ה-DNA של הנגיף. כדי לרצף מקטעים ארוכים, פותחה שיטת הריצוף שוטגאן, שבה המקטע הארוך מחולק באופן אקראי למקטעים קצרים, ולאחר מכן נעשה שימוש בחלקים חופפים כדי להרכיב מחדש את המקטע הארוך. בראשית שנות ה-80 של המאה ה-20 הרברט פול ועמיתים פיתחו שיטה שאינה משתמשת בחומרים רדיואקטיביים כדי להעביר תגובות ריצוף למטריצה מקובעת במהלך אלקטרופורזה. התפתחות זו אפשרה לחברת GATC ביוטק לייצר את מכונת הריצוף הראשונה, ששימשה לפענוח רצף כרומוזום II של שמר האפייה. בשנת 1986 לירוי הוד מהמכון הטכנולוגי של קליפורניה הכריז על מכונת ריצוף חצי אוטומטית, ושנה לאחר מכן חברת Applied Biosystems השיקה מכונת ריצוף אוטומטית לחלוטין. בשנה זו חברת דופונט הפיצה מכונת ריצוף שבה נעשה שימוש בסמן פלואורסצנטי כדי להבדיל בין ארבעת הנוקליאוטידים כך שניתן להפריד ביניהם ביתר קלות. באמצעות כלים אלו המכונים הלאומיים לבריאות החלו לרצף גנומים של יצורים שונים, ובהם Escherichia coli, Caenorhabditis elegans, מיקופלזמה, ושמר האפייה, בעלות של 0.75$ לנוקליאוטיד. במקביל, במעבדתו של קרייג ונטר ריצפו את ה-cDNA האנושי כדי לגלות את חלקי הגנום שעוברים שיעתוק. בשנת 1995 ונטר, המילטון או. סמית' ועמיתים פרסמו את הגנום הראשון השלם של יצור – החיידק Haemophilus influenzae. הגנום המעגלי שלו מכיל 1,830,137 זוגות בסיסים. שיטות אלו שימשו גם בסיס לפרויקט גנום האדם.
המעבר לשיטות ריצוף מהדור החדש
עריכהבמהלך שנות ה-90 של המאה ה-20 פותחו שיטות נוספות לריצוף DNA, שהוטמעו במכונות ריצוף שונות. שיטות אלו נקראו שיטות ריצוף מהדור החדש (next-generation sequencing), הידוע בקיצור NGS, כדי לבדל אותן מהשיטות המוקדמות. בשיטות אלו ניתן לרצף גנום שלם בהרצה בודדת, לרוב באמצעות חלוקתו למקטעים קצרים שמרוצפים במקביל במכונת ריצוף. בתקופה זו התפתחה גם שיטה נוספת לזיהוי רמות ביטוי של גנים, הנקראת מערך DNA, ומתבססת על עיצוב שבב עם מקטעי DNA חד-גדיליים, ומדידת עוצמת הפלואורסצנציה הנוצרת מיצירת דו-גדיל בין ה-DNA בשבב ל-DNA שמוסיפים.
בשנת 1996 פותחה שיטת ריצוף המתבססת על זיהוי של שחרור פירופוספט בעת הוספת נוקליאוטיד; השיטה, שנקראת Pyrosequencing, פותחה על ידי מוסטפא רונגי ופל ניירן במכון המלכותי לטכנולוגיה בסטוקהולם[9]. בשנת 1997 פסקל מאייר ולורן פרנילי רשמו פטנט על טכנולוגיה להכנת DNA לריצוף בתפוקה גבוהה, כולל שלב של הגברת מקטעי DNA על גבי שבב. פטנט זה, יחד עם שיטה נוספת שפותחה על ידי רוג'ר טסיין משמשת כבסיס לשיטות ריצוף בתפוקה גבוהה של חברת אילומינה. הזמינות של שיטות לריצוף בתפוקה גבוהה מאיצה את עידן הרפואה המותאמת אישית. עם זאת, יש להתאים כלים חישוביים כדי להתמודד עם כמויות המידע המתקבלות משיטות אלו.
שיטות בסיסיות לריצוף
עריכהשיטת מקסם-גילברט
עריכה- ערך מורחב – ריצוף מקסאם-גילברט
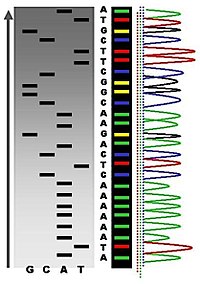
שיטה זו דורשת סימון רדיואקטיבי בקצה 5' של ה-DNA. ארבעה טיפולים כימיים שונים במולקולה גורמים ליצירת שברים מסוימים ב-DNA (G, A+G, C, C+T), אשר מטופלים בריכוז כזה שיגרום שבר אחר פר מולקולת DNA. כך נוצרת ספרייה של מקטעי DNA באורכים משתנים, החל מהקצה המסומן. על ידי הפרדת המקטעים באמצעות הרצה בג'ל אלקטרופורזה, ניתן להסיק את זהות הבסיס בכל עמדה. מורכבות השיטה והשימוש בחומרים רדיואקטיביים, יחד עם התפתחות שיטות ריצוף אחרות צמצמה את השימוש בשיטת ריצוף זו.
שיטת סנגר
עריכה- ערך מורחב – שיטת סנגר
שיטת ריצוף ה-DNA הנפוצה ביותר היא השיטה שפותחה על ידי פרדריק סנגר בשנת 1975[10] ושוכללה ב-1977.[11] על פיתוח השיטה והשימוש בה, זכה סנגר בפרס נובל שני בכימיה בשנת 1980. בשיטה זו משתמשים בפריימרים (תחלים) המתאימים לרצף DNA הצמוד לקטע אותו רוצים לרצף, ובאנזים DNA פולימראז, המשמש להארכת התחל ליצירת רצף משלים לקטע ה-DNA. בנוסף, יש לספק לתגובה האנזימטית גם dNTPs מארבעת הסוגים (אדנין (A), גואנין (G), תימין (T) וציטוזין (C)). מבצעים ארבע תגובות מקבילות שלכל אחת מהן מספקים גם ddNTP אחד (C, T, A או G) בו יש מימן (במקום הידרוקסיל) גם בעמדה '3 בנוסף לעמדה '2. שילוב של ddNTP ברצף ה-DNA המסונתז במבחנה מביא לעצירת הפולימריזציה. כך, מתקבלים מגוון רצפים שנקטעו באורכים שונים. הרצת תוצרי התגובות האנזימטיות בג'ל אגרוז בעל יכולת הפרדה של נוקלאוטיד אחד מספקת את הרצף. בכל מבחנה יהיו תוצרים שאורכם הוא המרחק מהתחל ועד הבסיס/הנוקלאוטיד המסוים שהוסף לאותה תגובה בתור ddNTP. בשיטה זו יש פחות שימוש בחומרים מסוכנים וברדיואקטיביות, והיא נחשבת פשוטה יותר משיטת מקסם-גילברט. לכן מכונות הריצוף הראשונות שפותחו התבססו על שיטה זו. במהלך השנים פותחו שיכלולים רבים לשיטת הריצוף לפי סנגר, כגון שימוש בסימון פלאורוסנטי, אלקטרופורזה קפילרית, ואוטומציה של שלבים רבים. שיפורים אלו הפכו את תהליך הריצוף למהיר יותר וגם הורידו את מחירו, מ-100,000,000$ לריצוף גנום האדם בשנת 2001 ועד 1,000$~ בשנת 2020.
שיטות מהדור החדש לריצוף בתפוקה גבוהה
עריכהבשונה משיטת סנגר, השיטות מהדור החדש (next-generation sequencing) אינן נסמכות על זיהוי הרצף על ידי עצירת הפולימריזציה בכל עמדה ברצף בעזרת נוקלאוטידים מסוג ddNTP ובהרצה בג'ל. במרבית השיטות החדשות מתבצע זיהוי הרצף על בסיס העיקרון "ריצוף על ידי סינתזה" (sequencing by synthesis), כלומר זיהוי הרצף של מולקולת DNA חד-גדילית מסוימת מבוצע במהלך הפולימריזציה של הגדיל המשלים ונסמך עליה.
עם שיטות אלו נמנות השיטות הבאות (פירוט מתחת לטבלת ההשוואה):
- ריצוף בשיטת 454 (Pyrosequencing 454).
- ריצוף בשיטת אילומינה (Illumina dye sequencing).
- ריצוף בשיטת Ion (Ion semiconductor sequencing).
- ריצוף SOLiD (SOLiD sequencing).
- ריצוף בשיטת Nanoball (Nanoball sequencing).
| שיטה | Single-molecule real-time sequencing (Pacific Bio) | Ion semiconductor (Ion Torrent sequencing) | Pyrosequencing (454) | ריצוף באמצעות סינתזה (אילומינה) | ריצוף באמצעות ליגציה (ריצוף SOLiD) | ריצוף סנגר |
|---|---|---|---|---|---|---|
| אורך קריאות | 5,500 בסיסים עד 8,500 בסיסים בממוצע (10,000 בסיסים N50); אורך קריאה מרבי >30,000 בסיסים[14][15] | עד 400 בסיסים | 700 בסיסים | 50 עד 300 בסיסים | 50+35 או 50+50 בסיסים | 400 עד 900 בסיסים |
| דיוק | 99.999% דיוק קונצנזוס; 87% דיוק של קריאה בודדת[16] | 98% | 99.9% | 98% | 99.9% | 99.9% |
| קריאות בהרצה | 50,000 לכל תא SMRT, או ~400 מיליון בסיסים[17][18] | עד 80 מיליון | 1 מיליון | עד 3 מיליארד | 1.2 עד .4 מיליארד | N/A |
| זמן הרצה | 30 דקות עד שעתיים | שעתיים | 24 שעות | 1 עד 10 ימים, כתלות במרצף ובאורך הקריאות[19] | שבוע עד שבועיים | 20 דקות עד 3 שעות |
| מחיר למיליון בסיסים (בדולרים) | $0.33-$1.00 | $1 | $10 | $0.05 עד $0.15 | $0.13 | $2400 |
| יתרונות | אורך קריאה ארוך. מהיר. זיהוי מתילציות 4mC, 5mC, 6mA.[20] | ציוד זול. מהיר. | אורך קריאה ארוך. מהיר. | פונטנציאל לתפוקה רבה, תלוי בדגם המרצף והיישום המבוקש. | מחיר זול לכל בסיס. | קריאות בודדות ארוכות. שימושי ליישומים שונים. |
| חסרונות | תפוקה בינונית. הציוד עשוי להיות יקר. | שגיאות הומופולימרים. | ההרצות יקרות. שגיאות הומופולימרים. | הציוד עשוי להיות יקר. נדרש ריכוז גבוה של DNA. | איטי מיתר השיטות. בעיות בריצוף פלינדרומים.[21] | יקר ולא ישים לפרויקטים גדולים. |
פירוסיקוונסינג
עריכה- ערך מורחב – פירוסיקוונסינג
שיטת ריצוף באמצעות סינתזה, המבוססת על זיהוי שחרור של פירופוספט כשמתחבר נוקלאוטיד לרצף. השיטה הוצגה על ידי מוסטפא רונגי (בפרסית: مصطفی رونقی) ופול נירן (בשוודית: Pål Nyrén) מהמכון הטכנולוגי המלכותי בסטוקהולם ב-1996.
בשיטה נעזרים בDNA פולימראז הבונה את הרצף המשלים לרצף שאותו רוצים לרצף, כשלצידו נמצא אנזים כימולומיניסנטי (הפולט אור). במהלך הריצוף מוסף בכל פעם dNTP שונה, ואם הנוקלאוטיד מתאים לרצף, הוא מתחבר ונפלט פירופוספט. אנזים ATP סולפורילאז יותר מהפירופוספט ATP, המשמש את הלוציפראז ללוציפרין לאוקסולוציפרין הפולט אור. לאחר מכן מנוקים כל ה-dNTPs שלא נקשרו באמצעות ADPase המפרק אותם, וממשיכים בריצוף באמצעות נוקלאוטיד שונה.
אילומינה
עריכה- ערך מורחב – ריצוף אילומינה
השיטה פותחה על ידי חוקרים בחברת Manteia Predictive Medicine (שנרכשה על ידי חברת סולקסה [Solexa] ב-2004) וסולקסה עצמה, שגם היא נרכשה לאחר מכן על ידי חברת אילומינה.
שיטה זו מבוססת על שימוש בסמנים פלואורסצנטיים הפיכים שמאפשרים לזהות בסיסים בודדים בעת שהם מצורפים לרצף ה-DNA. מקטעי DNA קצרים נקשרים לשבב, ומוגברים עליו, ליצירת אות חזק מספיק שניתן לקלוט אותו באמצעות אופטיקה ייעודית. ארבעה סוגים של בסיסים מוספים (אדנין, תימין, ציטוזין וגואנין), כאשר כל אחד צבוע פלואורסצנטית בצבע אחר ומחובר לקבוצה חוסמת החוסמת את הצבע. ארבעת סוגי הבסיסים מתחרים על אזורי הקישור בתבנית ה-DNA לטובת הריצוף ומולקולות שלא נקשרו נשטפות, ומתבצעת קריאה של האותות הפלואורסצנטיים באורכי הגל הרלוונטיים. אחרי כל סינתזה, מסירים באמצעות לייזר את הקבוצה החוסמת בקצה ה-3'. התהליך חוזר על עצמו עד שכל מולקולת ה-DNA מרוצפת. בין כל הוספה של נוקלאוטידים יש צורך בשטיפות.
שיטת Ion
עריכהשיטה זו מבוססת על זיהוי פרוטון (יון מימן) המשתחרר בזמן פולימריזציית DNA. זוהי שיטה בה הריצוף מתבצע על ידי סינתזה, שבמהלכה הגדיל המשלים נבנה על גבי רצף גדיל המקור. אל מיקרו-באריות, המכילות את גדיל המקור מ-DNA אותו מעוניינים לרצף, מוזרמים לסירוגין בסיסי DNA – דהאוקסינוקלאוטיד פוספט, סוג אחד של חומצת גרעין בכל מחזור פעולה. אם הבסיס המוצג משלים לנוקלאוטיד המוביל בגדיל המקור, הוא מצורף אל הגדיל המשלים המסונתז, תוך כדי פליטת יון מימן, המאותת לחיישן יונים וזה מזהה כי התגובה התרחשה בעקבות השינוי בערך ההגבה (pH). אם ישנן חזרות ברצף המקור, מספר נוקלאוטידים יצורפו במחזור אחד. התרחשות זו תגרור אחריה פליטת יוני מימן בהתאם וכן עלייה פרופורציונית בעוצמת האיתות החשמלי.
SOLiD
עריכהSOLiD (Sequencing by Oligonucleotide Ligation and Detection; ריצוף באמצעות קשירה וזיהוי של אוליגונוקלאוטידים) היא שיטה שפותחה על ידי Applied Biosystems. הריצוף מבוסס על שני בסיסים המסומנים עם סמן פלואורסצנטי.
שיטות בפיתוח
עריכה- ערך מורחב – תעלות מרצפות
שיטת תעלות מרצפות, היא שיטת ריצוף חדשנית המצויה בשלבי פיתוח מתקדמים וטרם זמינה בשוק. השיטה מבוססת על חדירת מולקולת DNA חד-גדילית דרך תעלות חלבוניות, בעלות קוטר של ננומטרים בודדים, הנעוצות בממברנה טבעית או מלאכותית. העברת הממברנה לתמיסה פיזיולוגית, והטענת שני צידי הממברנה במטען חשמלי מנוגד מאפשרת תנועה של גדיל ה-DNA מצידה האחד של הממברנה לצידה האחר דרך הננו-תעלות. מעבר של בסיסים שונים ברצף החד-גדיל דרך התעלה מביא לשינוי במתח הממברנה, והואיל וכל אחד מארבעת הבסיסים המצויים בDNA גורם לשינוי אחר במתח הממברנה ניתן לזהותו על ידי מדידת המתח, כך שמעבר הגדיל השלם מאפשר את זיהוי הרצף כולו. יתרונותיה העיקריים של השיטה הם מהירות הריצוף ועלותו הנמוכה, הואיל והשיטה אינה דורשת שימוש באנזימים, כגון DNA פולימראז או בנוקלאוטידים מסומנים פלואורסצנטית, אך חסרונה העיקרי הוא אחוז שגיאות גבוה.
ישנן שיטות ריצוף נוספות שעושות שימוש בננו-תעלות, ובהן מתבצע זיהוי הבסיסים ברצף באמצעות סימונם בפלואורסצנציה שונה, ותוך פולימריזציה של גדיל משלים לחד-גדיל המרוצף על ידי DNA פולימראז או על ידי עיכולו בסיס-אחר-בסיס בעזרת אקסונוקלאז.
הקלט והפלט של הריצוף
עריכהבשיטות הריצוף המוקדמות, שבהן מרוצפת בכל פעם מולקולה אחת של DNA, יש צורך להגדיל את מספר העותקים שלה כדי שיהיה ניתן להבחין בסימון הנוקליאוטידים. לצורך כך, יש להפיק את ה-DNA הרצוי וליצור ממנו עותקים זהים – באמצעות PCR או שיבוט. בשיטות ריצוף מהדור החדש יש להכין ספרייה שכוללת מקטעי DNA שונים, שייעודית לטכנולוגיית הריצוף הרצויה. בתוך מכונת ההרצפה, באזורים ייעודים המבדילים בין המקטעים השונים, מבוצעת תגובת PCR כדי להעלות את כמות העותקים לסף החישה של המכונה.
מכונות ההרצפה השונות נותנות לרוב כפלט קובץ טקסט בפורמט FASTQ. קובץ זה מכיל מידע על תוכן רצף ה-DNA, ועל איכות הקריאה, לפי ציון פרד. ישנן תוכנות שונות שבאמצעותן ניתן לבצע אנליזה לתוצאות הריצוף, כגון התוכנה החינמית גלקסי.
שימושים
עריכהניתן להשתמש בריצוף כדי לפענח תוכן הן של גן בודד והן של גנום שלם. ריצוף DNA הוא השיטה הטובה היעילה ביותר לפענח בצורה עקיפה רצפי RNA וחלבונים. למעשה, ריצוף DNA הפך לטכנולוגיה מרכזית ברוב תחומי הביולוגיה ובתחומים משיקים, כגון זיהוי פלילי ואנתרופולוגיה.
ביולוגיה מולקולרית
עריכה- ערך מורחב – ביולוגיה מולקולרית
בביולוגיה מולקולרית נעשה שימוש בריצוף כדי לחקור גנומים ולאפיין את פרופיל השעתוק, באמצעות המרת רצפי RNA ל-cDNA. ההתפתחויות בתחום ה-DNA הרקומביננטי הלכו יד ביד עם התקדמות טכנולוגיות הריצוף, בעקבות המידע שהצטבר.
המידע האצור ברצפים יכול ללמד את החוקרים על שינויים שחלים ברצפים במצבים מסוימים, הקשר בין רצפים למחלות ולזיהוי מטרות לטיפול. בנוסף, ידיעת הרצף מאפשרת לתכנן ביעילות מגוון רחב של שיטות מולקולריות שונות המשמשות למחקר ולהנדסה גנטית. פותחו שיטות רבות המתבססות על ריצוף DNA, כגון ChIP-seq שמזהה אתרי קישור של חלבונים ל-DNA.
ביולוגיה אבולוציונית
עריכהמכיוון ש-DNA עובר בתורשה, DNA משמש למחקרים בתחום הביולוגיה האבולוציונית, כדי לחקור את התפתחותם של יצורים ואת הקשרים ביניהם. בפברואר 2021 חוקרים פרסמו רצף DNA של ממותה שגילה מוערך ביותר ממיליון שנה, וזהו רצף ה-DNA העתיק ביותר שרוצף עד היום.
מטא-גנומיקה
עריכה- ערך מורחב – מטא-גנומיקה
מטא-גנומיקה הוא תחום מדעי העוסק בחקר של כלל החומר הגנטי שנאסף מדגימות סביבתיות, כגון דגימות אדמה, ביוב, מים, אוויר ודגימות מיצורים. הידע אילו יצורים מאכלסים סביבות חשוב לחוקרים בתחומים רבים, כגון אקולוגיה, אפידמיולוגיה ומיקרוביולוגיה. בעזרת ריצוף ניתן לדעת, לדוגמה, אילו מיקרובים מרכיבים מיקרוביום מסוים.
וירולוגיה
עריכה- ערך מורחב – וירולוגיה
רוב הנגיפים הם קטנים מדי מכדי לצפות בהם באמצעות מיקרוסקופ אור, וריצוף הגנום שלהם הוא כלי מרכזי בזיהוים ובמחקר אודותיהם. בעזרת מעקב אחרי שינויים ברצפי הגנום ניתן לעקוב אחר התפשטות נגיפים, באמצעות מעקב אחרי השעון המולקולרי. במאגר ה-GenBank יש למעלה מ-2.3 מיליון רצפים ייחודיים של נגיפים, שרובם רוצפו בשיטות מהדור החדש. שיפורים טכנולוגיים הפכו את הריצוף הגנטי לכלי מרכזי במאבק בקורונה – מפיתוח חיסון במהירות ועד מעקב אחר וריאנטים חדשים. מומחים צופים כי הטכניקה תיכנס לשימוש נרחב ברפואה, וחוזים כי זו תהיה "הבדיקה הקלינית היעילה והחשובה ביותר"[22].
רפואה
עריכה- ערך מורחב – רפואה מותאמת אישית
ניתן לרצף גנומים של בני-אדם כדי לגלות את הסיכון למחלות גנטיות. זהו סוג של בדיקת סקר גנטית, ולרוב לא מרצפים את הגנום בשלמותו, אלא רק את האזורים המקודדים, הידועים בשם אקסום, ומהווים כ-1%–2% מהגנום. אם בדיקה זו לא מגלה את שורש הבעיה, ניתן לפנות לריצוף הגנום כולו. באמצעות פענוח רצף DNA של מטופל יכול המטפל להתאים לו טיפול מתאים.
ראו גם
עריכהקישורים חיצוניים
עריכה- ארז גרטי, ריצוף DNA, במדור "מאגר המדע" באתר של מכון דוידסון לחינוך מדעי, 5 ספטמבר 2009
- ניו יורק טיימס, בחסות מגפת הקורונה מתחוללת מהפכה עולמית בתחום הריצוף הגנטי, באתר הארץ, 4 באפריל 2021
- ריצוף DNA, באתר אנציקלופדיה בריטניקה (באנגלית)
- גדעון לב, גוגל הציגה קטלוג מוטציות גנטיות מסוכנות, באתר הארץ, 21 בספטמבר 2023
- קסניה ז'ורבל, איך מחלצים DNA מעצמות שרופות?, במדור "שאל את המומחה" באתר של מכון דוידסון לחינוך מדעי, 28 בינואר 2024
ביאורים
עריכההערות שוליים
עריכה- ^ לפי החלטת האקדמיה ללשון העברית במילון ביולוגיה: מיקרוביולוגיה (תשנ"ה), 1994
- ^ Miescher, Friedrich (1871). "Ueber die chemische Zusammensetzung der Eiterzellen". Medicinisch-chemische Untersuchungen 4: 441–460.
- ^ סימוכין לפסקה: ג'ון גריבין, היסטוריה של המדע: 1543–2001, (תרגום מאנגלית: דפנה לוי), ספרי עליית הגג - סדרת מדע ופילוסופיה, הוצאת ידיעות ספרים, אוגוסט 2010. ISBN 9789655114997, עמ' 596–597
- ^ From Proteins to DNA, Oregon State University
- ^ Linus Pauling, Robert B. Corey, and H. R. Branson, The Structure of Proteins, PNAS, April 1951
- ^ Pauling, Linus (1901-1994), ScienceWorld
- ^ Proteins, Passports, and the Prize (1950-1954), Oregon State University
- ^ F. Sanger, S. A. (1977). DNA seqencing with chain-terminating inhibitors. PNAS, 74 (12), 5463-5467.
- ^ http://genome.cshlp.org/content/11/1/3.short
- ^ F. Sanger, A.R Coulson, "A rapid method for determining sequences in DNA by primed synthesis with DNA polymerase", Journal of Molecular Biology, 1975
- ^ F. Sanger, S. Nicklen, A.R Coulson, "DNA sequencing with chain-terminating inhibitors", PNAS, 1977
- ^ Quail, Michael; Smith, Miriam E; Coupland, Paul; et al. (1 בינואר 2012). "A tale of three next generation sequencing platforms: comparison of Ion torrent, pacific biosciences and illumina MiSeq sequencers". BMC Genomics. 13 (1): 341. doi:10.1186/1471-2164-13-341. PMC 3431227. PMID 22827831.
{{cite journal}}: (עזרה) - ^ Liu, Lin; Li, Yinhu; Li, Siliang; et al. (1 בינואר 2012). "Comparison of Next-Generation Sequencing Systems". Journal of Biomedicine and Biotechnology. Hindawi Publishing Corporation. 2012: 1–11. doi:10.1155/2012/251364.
{{cite journal}}: (עזרה) - ^ New Products: PacBio's RS II; Cufflinks | In Sequence | Sequencing | GenomeWeb
- ^ Pacific Biosciences Introduces New Chemistry With Longer Read Lengths
- ^ http://www.nature.com/nmeth/journal/v10/n6/full/nmeth.2474.html
- ^ De novo bacterial genome assembly: a solved problem? | In between lines of code
- ^ Rasko, David A.; Webster, Dale R.; Sahl, Jason W.; et al. (25 באוגוסט 2011). "Origins of the Strain Causing an Outbreak of Hemolytic–Uremic Syndrome in Germany". N Engl J Med. 365 (8): 709–717. doi:10.1056/NEJMoa1106920.
{{cite journal}}: (עזרה) - ^ van Vliet, Arnoud H.M. (1 בינואר 2010). "Next generation sequencing of microbial transcriptomes: challenges and opportunities". FEMS Microbiology Letters. 302 (1): 1–7. doi:10.1111/j.1574-6968.2009.01767.x.
{{cite journal}}: (עזרה) - ^ Murray, I. A.; Clark, T. A.; Morgan, R. D.; Boitano, M.; Anton, B. P.; Luong, K.; Fomenkov, A.; Turner, S. W.; Korlach, J.; Roberts, R. J. (2 באוקטובר 2012). "The methylomes of six bacteria". Nucleic Acids Research. 40 (22): 11450–62. doi:10.1093/nar/gks891. PMC 3526280. PMID 23034806.
{{cite journal}}: (עזרה)תחזוקה - ציטוט: multiple names: authors list (link) - ^ Yu-Feng Huang, Sheng-Chung Chen, Yih-Shien Chiang, Tzu-Han Chen & Kuo-Ping Chiu (2012). "Palindromic sequence impedes sequencing-by-ligation mechanism". BMC systems biology. 6 Suppl 2: S10. doi:10.1186/1752-0509-6-S2-S10. PMID 23281822.
{{cite journal}}: תחזוקה - ציטוט: multiple names: authors list (link) - ^ הניו יורק טיימס, מתחוללת מהפכה בתחום הריצוף הגנטי, באתר הארץ, 4 באפריל 2021